1º Enlace iónico: Une átomos electropositivos de la izquierda de la tabla con átomos electronegativos no metálicos de la derecha de la tabla de la tabla, ya que los electropositivos tienden a perder e- y los electronegativos tienen a ganarlos. El enlace iónico consiste en la transferencia de e- de átomos electropositivos a átomos electronegativos.
Na11 = 1s2 2s2 2p6 3s2 ------ Na + 11+
10 -
Cl17 = 1s2 2s2 2p6 3s2 3p5 -------- Cl - 17-
18+
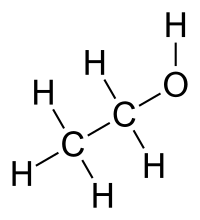
2º Enlace covalente: Sirve para unir átomos muy electronegativos de la derecha de la tabla. Este enlace se forma por compartimiento de e- hasta conseguir el octeto. Cada enlace se forma con un par de e- compartidos.
- Representación de Lewis:
Enlace Cl - Cl Molécula de Cl2 (gas)
Enlace H - H
Enlace N - N
Enlace O = O
Hay algunas excepciones a la regla del octeto, como son el BCl3 y PCl3
3º Tipos de reacciones:
a/ Por la naturaleza de la reacción.
B/ Por la naturaleza de los reactivos.
Combustible + comburente --- CO2 + H2O
P tiene 10 e- B tiene 6 e-